يُشخَّص حوالي 1.2% من الأشخاص بسرطان الغدة الدرقية خلال حياتهم. خلال الأربعين عامًا الماضية، وبفضل الاستخدام الواسع للتصوير وإدخال خزعة الإبرة الدقيقة، ازداد معدل اكتشاف سرطان الغدة الدرقية بشكل ملحوظ، وتضاعفت حالات الإصابة به ثلاثة أضعاف. وقد تطور علاج سرطان الغدة الدرقية بسرعة خلال السنوات الخمس إلى العشر الماضية، مع حصول مجموعة متنوعة من البروتوكولات الجديدة على موافقة الجهات التنظيمية.
كان التعرض للإشعاع المؤين في مرحلة الطفولة مرتبطًا بشكل وثيق بسرطان الغدة الدرقية الحليمي (1.3 إلى 35.1 حالة لكل 10,000 شخص/سنة). وقد أظهرت دراسة جماعية، شملت 13,127 طفلًا دون سن 18 عامًا يعيشون في أوكرانيا بعد حادثة تشيرنوبيل النووية عام 1986، وجود 45 حالة إصابة بسرطان الغدة الدرقية، مع وجود خطر نسبي زائد للإصابة بسرطان الغدة الدرقية قدره 5.25/غراي. كما توجد علاقة بين الجرعة والاستجابة للإشعاع وسرطان الغدة الدرقية. فكلما كان عمر التعرّض للإشعاع المؤين أصغر، زاد خطر الإصابة بسرطان الغدة الدرقية المرتبط بالإشعاع، واستمر هذا الخطر لما يقرب من 30 عامًا بعد التعرّض.
معظم عوامل خطر الإصابة بسرطان الغدة الدرقية ثابتة: فالعمر، والجنس، والعرق، والتاريخ العائلي للإصابة بسرطان الغدة الدرقية هي أهم عوامل التنبؤ بالخطر. كلما تقدم العمر، ارتفع معدل الإصابة وانخفض معدل النجاة. سرطان الغدة الدرقية أكثر شيوعًا لدى النساء منه لدى الرجال بثلاث مرات، وهو معدل ثابت تقريبًا في جميع أنحاء العالم. يرتبط التباين الجيني في الخلايا الجرثومية لدى 25% من مرضى سرطان الغدة الدرقية النخاعي بمتلازمات الأورام الصماء المتعددة الموروثة من النوع 2أ و2ب. 3% إلى 9% من مرضى سرطان الغدة الدرقية جيد التمايز لديهم قابلية للتوريث.
أظهرت متابعة أكثر من 8 ملايين مقيم في الدنمارك أن تضخم الغدة الدرقية العقدي غير السام يرتبط بزيادة خطر الإصابة بسرطان الغدة الدرقية. في دراسة جماعية بأثر رجعي شملت 843 مريضًا خضعوا لجراحة الغدة الدرقية لعلاج عقيدة درقية أحادية أو ثنائية الجانب، أو تضخم الغدة الدرقية، أو مرض الغدة الدرقية المناعي الذاتي، ارتبط ارتفاع مستويات هرمون الثيروتروبين (TSH) في المصل قبل الجراحة بسرطان الغدة الدرقية: 16% من المرضى الذين لديهم مستويات TSH أقل من 0.06 ملي وحدة دولية/لتر أصيبوا بسرطان الغدة الدرقية، بينما أصيب 52% من المرضى الذين لديهم TSH ≥ 5 ملي وحدة دولية/لتر بسرطان الغدة الدرقية.
غالبًا ما لا تظهر أي أعراض على المصابين بسرطان الغدة الدرقية. أظهرت دراسة استعادية أجريت على 1328 مريضًا بسرطان الغدة الدرقية في 16 مركزًا في 4 دول أن 30% فقط (183 من أصل 613) ظهرت عليهم أعراض عند التشخيص. عادةً ما تكون حالة المرضى الذين يعانون من كتلة في الرقبة، وصعوبة في البلع، وإحساس بوجود جسم غريب، وبحة في الصوت، أكثر خطورة.
يظهر سرطان الغدة الدرقية عادةً على شكل عقدة درقية ملموسة. وتشير التقارير إلى أن نسبة الإصابة بسرطان الغدة الدرقية في العقد الملموسة تبلغ حوالي 5% و1% على التوالي، لدى النساء والرجال في المناطق التي يتوفر فيها اليود بكميات كافية من العالم. في الوقت الحالي، يُكتشف ما بين 30% و40% من سرطانات الغدة الدرقية من خلال الجس. تشمل طرق التشخيص الشائعة الأخرى التصوير غير المرتبط بالغدة الدرقية (مثل الموجات فوق الصوتية للشريان السباتي، والرقبة، والعمود الفقري، وتصوير الصدر)؛ ويخضع المرضى الذين يعانون من فرط نشاط الغدة الدرقية أو قصورها والذين لم يلمسوا العقد؛ ويُكرر تصوير العقدة الدرقية للمرضى الذين لديهم عقد درقية موجودة بالموجات فوق الصوتية؛ وقد تم اكتشاف سرطان الغدة الدرقية الخفي بشكل غير متوقع أثناء الفحص المرضي بعد الجراحة.
الموجات فوق الصوتية هي الطريقة المُفضّلة لتقييم عقيدات الغدة الدرقية الملموسة أو نتائج التصوير الأخرى لعقيدات الغدة الدرقية. تتميز الموجات فوق الصوتية بحساسية عالية في تحديد عدد وخصائص عقيدات الغدة الدرقية، بالإضافة إلى السمات عالية الخطورة المرتبطة بخطر الإصابة بالأورام الخبيثة، مثل التشوهات الهامشية، وتركيز الصدى القوي، وغزو الغدة الدرقية من الخارج.
في الوقت الحاضر، يُمثل الإفراط في تشخيص وعلاج سرطان الغدة الدرقية مشكلةً يوليها العديد من الأطباء والمرضى اهتمامًا خاصًا، وينبغي على الأطباء محاولة تجنب الإفراط في التشخيص. إلا أن تحقيق هذا التوازن صعب، إذ لا يستطيع جميع مرضى سرطان الغدة الدرقية المتقدم والنقيلي الشعور بعقيدات الغدة الدرقية، كما أن تشخيصات سرطان الغدة الدرقية منخفضة الخطورة لا يمكن تجنبها. على سبيل المثال، يمكن تشخيص سرطان الغدة الدرقية المجهري العرضي، الذي قد لا يُسبب أعراضًا أو يؤدي إلى الوفاة، نسيجيًا بعد جراحة لعلاج مرض الغدة الدرقية الحميد.
تُقدم العلاجات التداخلية قليلة التوغل، مثل الاستئصال بالترددات الراديوية الموجهة بالموجات فوق الصوتية، والاستئصال بالميكروويف، والاستئصال بالليزر، بديلاً واعداً للجراحة عندما يتطلب سرطان الغدة الدرقية منخفض الخطورة العلاج. على الرغم من اختلاف آليات عمل طرق الاستئصال الثلاثة قليلاً، إلا أنها متشابهة بشكل أساسي من حيث معايير اختيار الورم، واستجابته، ومضاعفات ما بعد الجراحة. يتفق معظم الأطباء حاليًا على أن الورم المثالي للتدخل طفيف التوغل هو سرطان حليمي داخلي في الغدة الدرقية قطره أقل من 10 مم، ويبعد أكثر من 5 مم عن الهياكل الحساسة للحرارة مثل القصبة الهوائية والمريء والعصب الحنجري الراجع. وتظل أكثر المضاعفات شيوعًا بعد العلاج هي إصابة العصب الحنجري الراجع القريب بالحرارة دون قصد، مما يؤدي إلى بحة مؤقتة في الصوت. لتقليل الضرر الذي يلحق بالهياكل المحيطة، يُنصح بترك مسافة آمنة بعيدًا عن الآفة المستهدفة.
أظهرت العديد من الدراسات فعالية وسلامة التدخل الجراحي طفيف التوغل في علاج سرطان الغدة الدرقية الحليمي الدقيق. على الرغم من أن التدخلات طفيفة التوغل لعلاج سرطان الغدة الدرقية الحليمي منخفض الخطورة قد حققت نتائج واعدة، إلا أن معظم الدراسات كانت بأثر رجعي وركزت على الصين وإيطاليا وكوريا الجنوبية. بالإضافة إلى ذلك، لم تُجرَ مقارنة مباشرة بين استخدام التدخلات طفيفة التوغل والمراقبة النشطة. لذلك، يُعد الاستئصال الحراري الموجه بالموجات فوق الصوتية مناسبًا فقط لمرضى سرطان الغدة الدرقية منخفض الخطورة غير المرشحين للعلاج الجراحي أو الذين يفضلون هذا الخيار العلاجي.
في المستقبل، قد يكون العلاج التداخلي طفيف التوغل خيارًا علاجيًا آخر للمرضى المصابين بسرطان الغدة الدرقية ذي الأهمية السريرية، مع خطر أقل للمضاعفات مقارنةً بالجراحة. منذ عام ٢٠٢١، استُخدمت تقنيات الاستئصال الحراري لعلاج مرضى سرطان الغدة الدرقية الذين يقل حجمهم عن ٣٨ مم (T1b~T2) والذين يعانون من سمات عالية الخطورة. ومع ذلك، شملت هذه الدراسات الاستعادية مجموعة صغيرة من المرضى (تراوحت أعمارهم بين ١٢ و١٧٢ مريضًا) وفترة متابعة قصيرة (بمتوسط ١٩.٨ إلى ٢٥ شهرًا). لذلك، هناك حاجة إلى مزيد من البحث لفهم أهمية الاستئصال الحراري في علاج مرضى سرطان الغدة الدرقية ذي الأهمية السريرية.
تظل الجراحة هي الطريقة الأساسية لعلاج سرطان الغدة الدرقية المتمايز المشتبه به أو المؤكد خلويًا. كان هناك جدل حول النطاق الأنسب لاستئصال الغدة الدرقية (استئصال الفص واستئصال الغدة الدرقية الكلي). يكون المرضى الذين يخضعون لاستئصال الغدة الدرقية الكلي أكثر عرضة للخطر الجراحي من أولئك الذين يخضعون لاستئصال الفص. تشمل مخاطر جراحة الغدة الدرقية تلف العصب الحنجري المتكرر وقصور الغدة جارة الدرقية ومضاعفات الجرح والحاجة إلى مكملات هرمون الغدة الدرقية. في الماضي، كان استئصال الغدة الدرقية الكلي هو العلاج المفضل لجميع سرطانات الغدة الدرقية المتمايزة التي يزيد حجمها عن 10 مم. ومع ذلك، أظهرت دراسة أجراها آدم وآخرون عام 2014 أنه لا يوجد فرق ذو دلالة إحصائية في معدل البقاء على قيد الحياة ومخاطر الانتكاس بين المرضى الذين يخضعون لاستئصال الفص واستئصال الغدة الدرقية الكلي لسرطان الغدة الدرقية الحليمي الذي يتراوح حجمه بين 10 مم و40 مم دون سمات سريرية عالية الخطورة.
لذلك، يُفضل حاليًا استئصال الفص عادةً لسرطان الغدة الدرقية أحادي الجانب جيد التمايز <40 مم. يُوصى عمومًا باستئصال الغدة الدرقية بالكامل لسرطان الغدة الدرقية جيد التمايز الذي يبلغ 40 مم أو أكبر وسرطان الغدة الدرقية الثنائي. إذا انتشر الورم إلى العقد الليمفاوية الإقليمية، فيجب إجراء تشريح العقد الليمفاوية المركزية والجانبية للرقبة. يحتاج فقط المرضى المصابون بسرطان الغدة الدرقية النخاعي وبعض سرطانات الغدة الدرقية كبيرة الحجم جيدة التمايز، بالإضافة إلى المرضى الذين يعانون من عدوانية الغدة الدرقية الخارجية، إلى تشريح العقدة الليمفاوية المركزية الوقائي. يمكن النظر في تشريح العقدة الليمفاوية العنقية الجانبية الوقائي للمرضى المصابين بسرطان الغدة الدرقية النخاعي. في المرضى الذين يُشتبه في إصابتهم بسرطان الغدة الدرقية النخاعي الوراثي، يجب تقييم مستويات البلازما من النورإبينفرين والكالسيوم وهرمون الغدة جار الدرقية (PTH) قبل الجراحة لتحديد متلازمة MEN2A وتجنب فقدان ورم القواتم وفرط نشاط الغدة جار الدرقية.
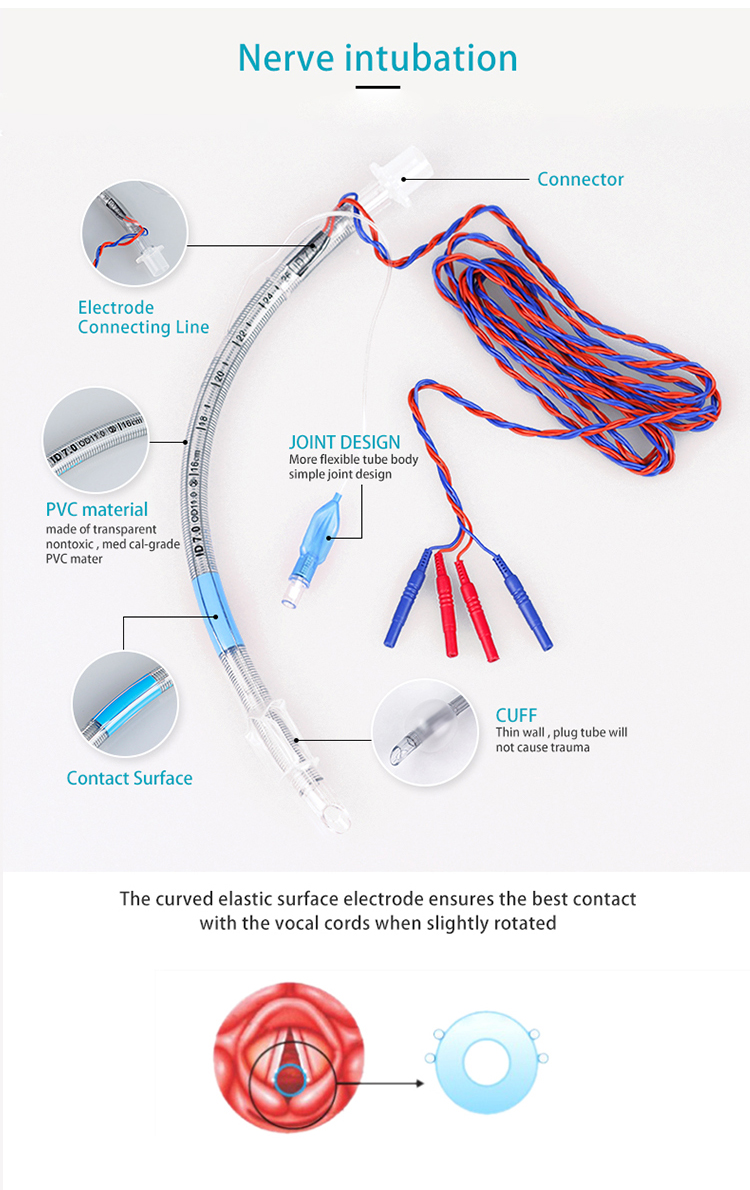
يتم استخدام التنبيب العصبي بشكل أساسي للاتصال بجهاز مراقبة الأعصاب المناسب لتوفير مجرى هوائي غير مزعج ومراقبة نشاط العضلات والأعصاب أثناء الجراحة في الحنجرة.
أنبوب الرغامي EMG انقر هنا للحصول على المنتج
وقت النشر: ١٦ مارس ٢٠٢٤